Bebês geneticamente modificados já não são mais coisa do futuro
Startup já analisou milhares de genomas de embriões em busca de alterações que possam resultar em doenças ou malformações

Nossas origens importam? Essa é a pergunta que está no centro da Orchid, uma das novas startups que realizam triagem genômica em embriões humanos.
Hoje, cerca de 40% dos ciclos de fertilização in vitro (FIV) incluem algum tipo de teste genético. Mas, na maioria dos casos, trata-se apenas de uma análise básica de anomalias cromossômicas – algo semelhante ao que se obtém em um exame de amniocentese.
A Orchid e suas concorrentes, todas fundadas na última década, oferecem algo muito mais abrangente – e potencialmente mais radical.
A fundadora e CEO da Orchid, Noor Siddiqui, de 31 anos, ainda não tem filhos, mas planeja, junto com o marido, ter dois meninos e duas meninas. Já congelou mais de uma dúzia de embriões e pretende coletar ainda mais óvulos.
Cada um deles foi submetido à biópsia; o DNA foi amplificado, sequenciado e recebeu uma pontuação não apenas para detectar anomalias cromossômicas, mas também para avaliar riscos de câncer, autismo, diabetes, malformações e centenas de outras doenças.
- Doenças raras: estudo mostra como IA pode apoiar médicos no diagnóstico; entenda
- As 10 tecnologias mais importantes de 2025, segundo o Fórum Econômico Mundial
- Bebê com doença rara é curado com tratamento inédito que pode mudar a história da medicina
- IA pode tornar a fertilização in vitro um processo mais acessível
Siddiqui acredita que as decisões mais importantes para quem quer ter filhos acontecem antes do nascimento: a escolha do parceiro e o genoma da criança. Ela enxerga a triagem genômica como medicina preventiva. “Pela primeira vez, os pais podem reduzir uma enorme quantidade de riscos que antes eram deixados ao acaso”, afirma.
A visão de futuro da empreendedora inclui relatórios de embriões com dados ricos, bem diagramados, que permitam a futuros pais eliminar da lista embriões com doenças raras graves e comparar riscos relativos em condições complexas, como esquizofrenia e deficiência intelectual. Para ela, essa prática será não só comum, mas essencial.
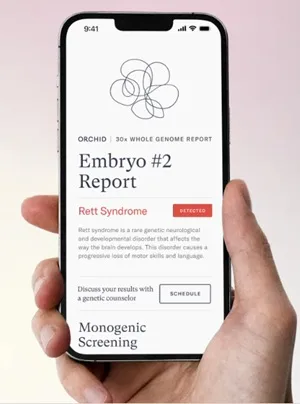
A motivação é pessoal: sua mãe perdeu a visão por conta de uma mutação genética. Na Universidade Stanford, onde estudou ciência da computação e inteligência artificial, Siddiqui descobriu o potencial de cruzar aprendizado de máquina com genética. “Eu vi o que aconteceu com minha mãe. Não quero que meus filhos sofram”, diz.
Desde sua fundação, em 2019, a Orchid já analisou milhares de genomas de embriões, ao custo de US$ 2,5 mil cada. A empresa vai além dos testes tradicionais de aneuploidia, oferecendo também pontuações de risco poligênico para doenças comuns como hipertensão e problemas cardíacos. Essas métricas, porém, são polêmicas na comunidade científica, já que fatores ambientais e comportamentais também pesam.
Ainda assim, famílias com histórico de doenças hereditárias e que dispõem de recursos financeiros não hesitam em recorrer à Orchid. O serviço, porém, levanta questões éticas: crianças são dádivas ou produtos otimizados? O modelo favorece casais com maior poder aquisitivo e reflete uma lógica de consumo que, na prática, pode significar "que vença o melhor bebê".
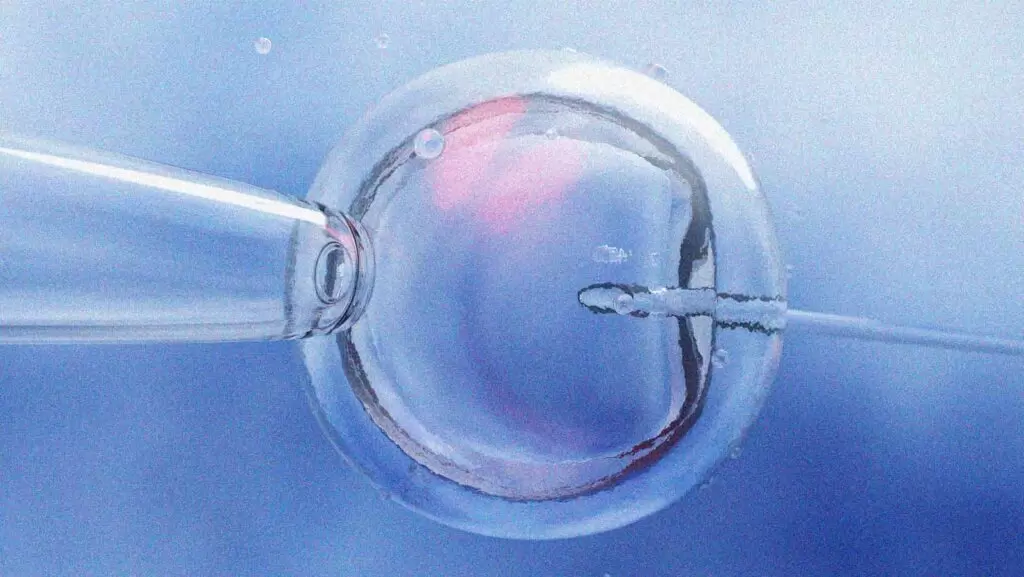
A startup atraiu investidores de peso do Vale do Silício, como Anne Wojcicki (23andMe) e Brian Armstrong (Coinbase). Para Siddiqui, que fez parte do programa de bolsas de Peter Thiel, a ênfase na escolha do consumidor é intencional. “Acredito que os consumidores são inteligentes. No fim das contas, o arco da história tende para o bem”, afirma.
Enquanto pesquisadores avaliam os efeitos populacionais da triagem genômica, países com sistemas públicos de saúde já consideram os potenciais ganhos de qualidade de vida e economia em longo prazo.
A ideia de reduzir riscos genéticos soa atraente, mas, como lembra a própria biologia, nem sempre o acaso é falha: muitos abortos espontâneos, causados por anomalias cromossômicas, são também um mecanismo natural de proteção.



















