EUA aprovam nova droga que retarda o avanço do Mal de Alzheimer
Aprovação do Kisunla foi baseada em estudo no qual os pacientes apresentaram declínio 22% mais lento em termos de memória e capacidade cognitiva
As autoridades dos EUA acabaram de aprovar outro medicamento para Alzheimer que pode retardar a doença, oferecendo uma nova opção para pacientes nos estágios iniciais desse mal incurável e devastador para a memória.
A Food and Drug Administration (FDA) aprovou o Kisunla, da farmacêutica Eli Lilly, para casos leves ou iniciais de demência causada pelo Alzheimer. Esse é apenas o segundo medicamento que demonstrou retardar o declínio cognitivo, após a aprovação de um medicamento semelhante da fabricante japonesa Eisai.
O atraso observado com ambos os medicamentos é de apenas alguns meses – cerca de sete meses, no caso do medicamento da Lilly. Os pacientes e suas famílias terão que pesar esse benefício em relação às desvantagens, incluindo injeções intravenosas em períodos regulares e efeitos colaterais potencialmente perigosos
Os médicos que tratam da doença de Alzheimer dizem que a aprovação é um passo importante depois de décadas de tratamentos experimentais fracassados. "Como especialista em demência, tem sido difícil. Diagnostico meus pacientes com Alzheimer e, a cada ano, vejo que eles vão piorando até morrer", diz Suzanne Schindler, neurologista da Universidade de Washington em St.Louis.
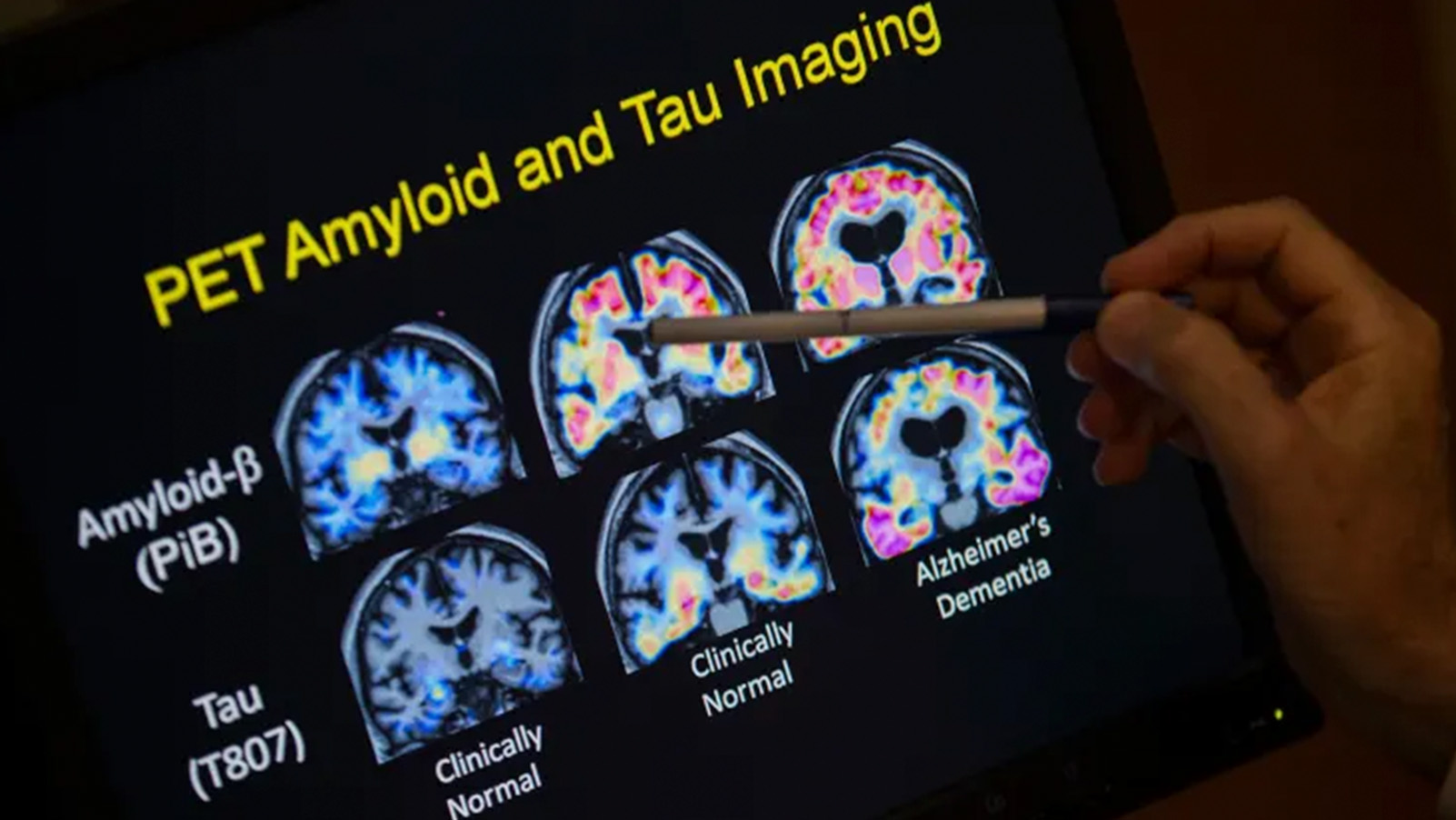
Tanto o Kisunla quanto o medicamento japonês, Leqembi, são anticorpos sintéticos administrados por via intravenosa que têm como alvo um dos fatores que contribuem para o Alzheimer, o acúmulo de placas amiloides gordurosas no cérebro. Ainda há dúvidas sobre quais pacientes deveriam receber os medicamentos e por quanto tempo eles podem se beneficiar.
Uma das vantagens é que os pacientes podem parar de tomar o remédio se responderem bem ao tratamento.
A aprovação estava prevista depois que um painel externo de consultores da FDA votou por unanimidade a favor de seus benefícios em uma reunião pública em junho.
Esse endosso ocorreu apesar de vários questionamentos dos revisores da FDA sobre como a Eli Lilly estudou o medicamento, inclusive permitindo que os pacientes interrompessem o tratamento depois que as placas atingissem níveis muito baixos.
Os custos vão variar de acordo com o paciente, dependendo do tempo de uso do medicamento, segundo a fabricante. Segundo a empresa, um ano de terapia custaria US$ 32 mil, valor superior aos US$ 26,5 mil de um ano de Leqembi.
As instruções de prescrição da FDA informam aos médicos que eles podem cogitar a interrupção da droga após confirmarem, por meio de exames cerebrais, que os pacientes têm um nível baixo de placas.
PRÓS E CONTRAS
A FDA aprovou o Kisunla, conhecido quimicamente como donanemab, com base nos resultados de um estudo de 18 meses no qual os pacientes que receberam o tratamento tiveram um declínio cerca de 22% mais lento em termos de memória e capacidade cognitiva do que aqueles que receberam um placebo.
A principal questão de segurança foi o inchaço e o sangramento no cérebro, um problema comum a todos os medicamentos direcionados à placa. O Leqembi deve ser aplicado duas vezes por mês, enquanto o Kisunla é injetado uma vez por mês – o que poderia facilitar a vida dos cuidadores que levam o paciente a um hospital ou clínica para tratamento.
O medicamento da Eli Lilly tem outra vantagem em potencial: os pacientes podem parar de tomá-lo se responderem bem ao tratamento.
No estudo clínico, os pacientes pararam de tomar o remédio quando a placa cerebral atingiu níveis baixos. A interrupção do medicamento poderia reduzir os custos e os riscos de segurança em relação ao uso prolongado. Ainda não está claro quando os pacientes poderão precisar retomar as aplicações.
Antes de começar qualquer tratamento, os médicos precisam confirmar que os pacientes com demência têm a placa cerebral afetada pelos novos medicamentos e encontrar um hospital ou clínica que disponibilize a terapia.
Enfermeiros e outros funcionários devem ser treinados para realizar exames periódicos para verificar se há inchaço ou sangramento no cérebro do paciente.
"Tudo isso são coisas que o médico precisa preparar", diz Mark Mintun, que dirige a divisão de neurociência da Eli Lilly. "Até que os médicos se acostumem com isso, essa terapia não será oferecida a nenhum paciente que chegue ao consultório."